近日,北京大学IDG麦戈文脑科学研究所、心理与认知科学学院、北大-清华生命科学联合中心王征实验室与复旦大学附属华山医院麻醉科王英伟主任团队、河南省人民医院王梅云副院长团队鼎力合作,在Advanced Science在线发表题为“State-specific regulation of electrical stimulation in the intralaminar thalamus of macaque monkeys: network and transcriptional insights into arousal”的学术论文。该研究融合神经影像、神经调控、RNA测序技术,同时从基因表达、信号通路、功能网络多个尺度揭示了深部电刺激丘脑板内核(intralaminar nuclei of thalamus, ILN)诱发麻醉猕猴快速觉醒的脑网络及人类物种保守的分子、细胞机制。
磁共振成像作为支撑平台技术,与电生理、光遗传、基因测序等多种技术快速发展结合(Finn et al., Nature, 2023),为探索大脑功能与行为表型的神经环路及生物学机制开辟了新道路。王征实验室长期聚焦神经影像和神经调控技术在脑科学与脑疾病中的应用,特别专注猕猴磁共振成像(Biol Psychiatry, 2016; Am J Psychiatry, 2021; Cell Discovery, 2021; eLife, 2022),近年来融合转录组学(Nat Commun, 2023; Cell Reports, 2023)、神经调控(Mol Psychiatry, 2022)等多个交叉方向取得了系列研究成果。丘脑与大脑皮层间的长程通讯,尤其是与丘脑板内核ILN相关的通讯被认为与觉醒(arousal)、意识紧密相关,例如Schiff等人通过电刺激ILN成功唤醒一位昏迷6年之久的植物人(Schiff et al., Nature, 2007)。然而,整合神经调控与神经影像技术来鉴定丘脑板内核与大脑皮层各个区域之间的连接网络十分挑战,而且对其背后的分子细胞机制迄今知之甚少。研究团队首先在猕猴模型上搭建了磁共振成像同步的深部脑刺激 (DBS)系统,且同时实现了3T磁场兼容的多导脑电记录标识丙泊酚麻醉深度的技术,在此基础之上研究电刺激ILN是否能唤醒处于不同麻醉深度的猕猴,以及对应的脑功能连接网络模式。随后基于团队前期构建的猕猴全脑转录组图谱(Nat Commun, 2023), 系统分析了ILN驱动觉醒网络的区域特异性、皮层分层特异及细胞特异性的基因表达谱,并结合美国艾伦脑研究所发布的人类大脑转录组图谱(Hawrylycz et al., Nature, 2012),评估觉醒在灵长类物种间的进化保守性,图1展示了整个课题设计逻辑思路和实验流程。
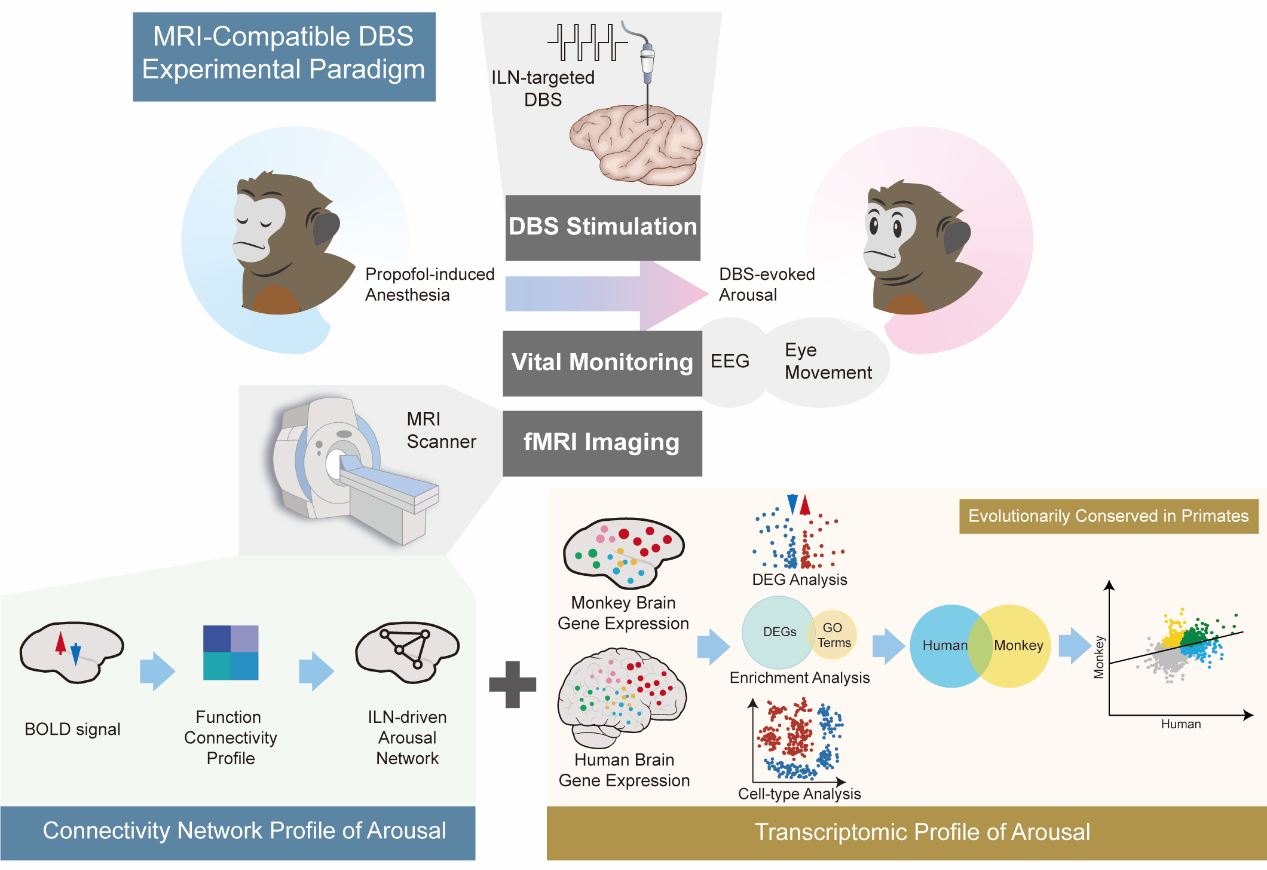
图1. 以脑功能影像网络为基础的转录组学跨物种比较实验方案
研究团队发现在猕猴丘脑板内核植入微电极后,应用200微安,200赫兹的电流刺激能够将猕猴从处于丙泊酚诱导的慢波振荡(slow-wave oscillations)状态中唤醒(表现为眼睛睁开、嘴巴蠕动以及明显的心跳加快,图2),但实施同样幅值频率的电刺激不能唤醒处于丙泊酚诱导等电位线(isoelectric lines)状态的猕猴。深入分析同步记录的功能磁共振成像信号,发现电刺激ILN诱发了额-顶-颞-枕叶以及壳核等多个区域的功能磁共振信号响应。这些脑区主要参与多模态感觉信息处理、感觉运动信息整合,由此形成了ILN驱动的觉醒网络。
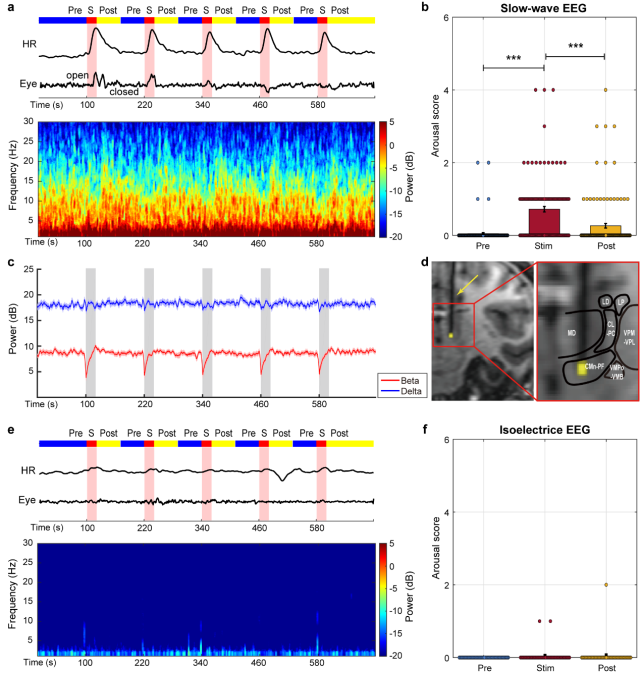
图2. 电刺激ILN可促使处于丙泊酚诱导慢波振荡状态下的猕猴快速觉醒
面对ILN刺激选择性激活的、分布在全脑不同区域形成的网络,研究人员非常好奇:为什么唯独是这些脑区产生响应?他们之间的通路有什么特异性的生物学机制吗?于是,研究团队创新性地提出功能网络偏好(network-biased)的转录组学分析,探究这个ILN驱动的觉醒网络与大脑其它地方的基因表达到底有什么不同。根据猕猴全脑转录组图谱中每个RNA采样的空间坐标位置,将覆盖全脑110个脑区的878个样本划分是否属于觉醒网络,并保留了15275个基因开展差异表达分析。结果如图3所示,发现其中2489个基因偏好表达于此觉醒网络(其中1290个基因上调,1199个下调)。针对这些差异基因,ClueGO分析揭示了三个与离子通道相关的集群--"离子转运"、"底物特异性通道活动 "和 "通道活动",凸显了离子通道在觉醒网络中的关键作用。接下来,分别对上调基因和下调基因进行了GO富集分析,发现上调基因高度富集了离子通道相关术语,包括表示生物过程的"离子转运"、"离子跨膜转运";细胞成分的"离子通道复合物"、 "钾通道复合物"、"电压门钾通道复合物";分子功能的"离子通道活性"、"阳离子通道活性"、"钾离子跨膜转运体活性"、"钾通道活性"等。蛋白-蛋白相互作用分析进一步确认了这些差异基因主要集中在电压门控钾离子通道上。此外,研究团队利用猴脑单细胞和皮层分层RNA测序数据,检验这些差异表达基因是否特异性地富集在某些细胞类型或者特定的皮层位置,结果发现显著富集在兴奋性神经元、表达小清蛋白的抑制性神经元和少突胶质细胞中。
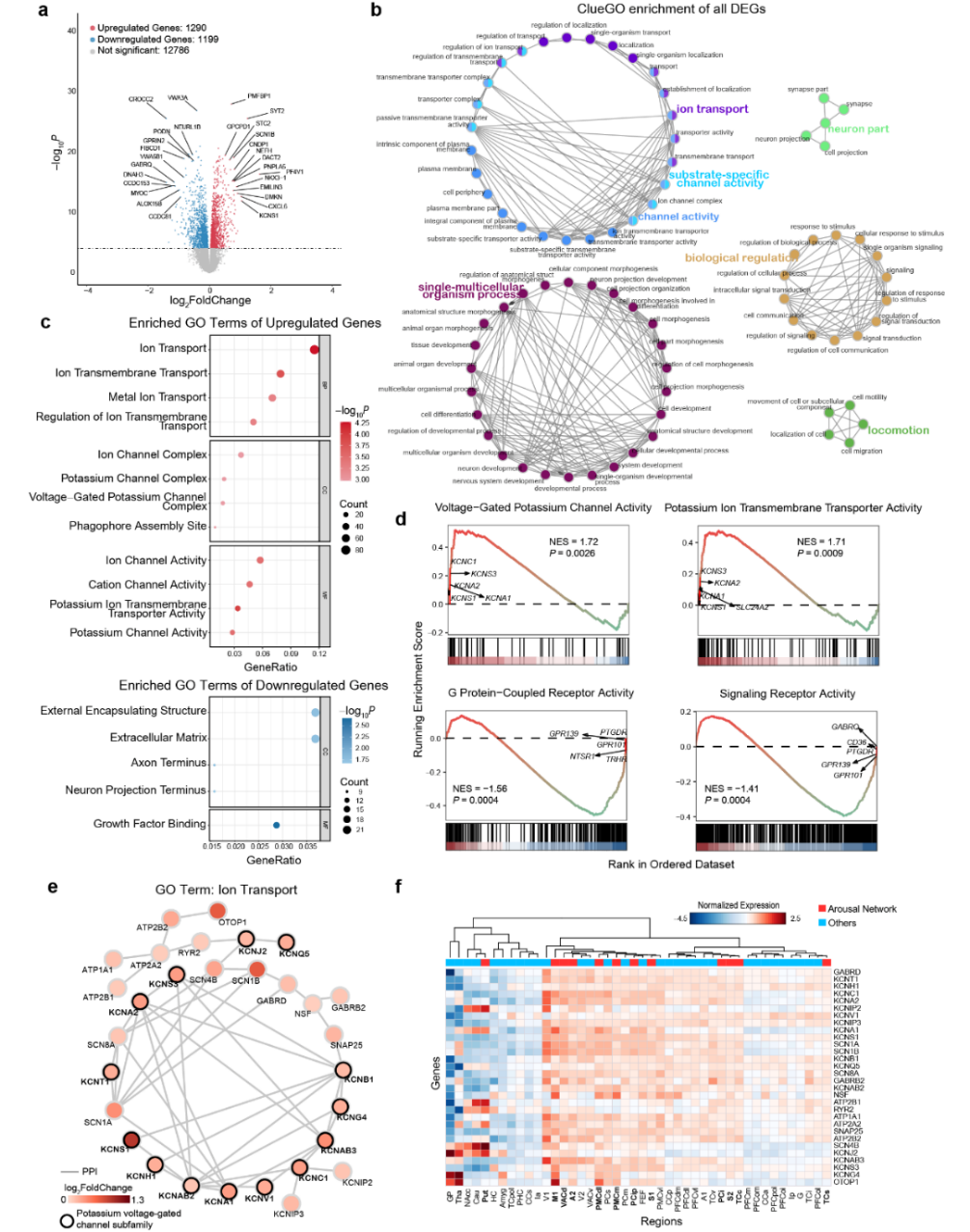
图3. ILN驱动的觉醒网络偏好的差异基因表达及富集结果
觉醒被认为是哺乳类物种间高度进化保守的功能之一。因此,研究团队将在猕猴上鉴别的觉醒网络映射到人类大脑上,同时结合Allen人脑转录组图谱数据进行跨物种比较。结果(图4)发现在猕猴和人类大脑觉醒网络中同时存在242个上调同源基因(占比30.87%)和110个下调同源基因(占比30.90%),且表达水平(log2FoldChange)显著相关(p<2.2×10-16)。这些同源基因在人脑中也是高度富集在钾离子通道,兴奋性神经元、表达小清蛋白的抑制性中间神经元上。这些结果显示了觉醒网络在灵长类间高度进化保守的分子和细胞架构,更是创新性地发展了高通量方法筛选基因、分子、细胞组成等信息解析觉醒网络特征。
值得强调的是,本项研究整合了神经影像和神经调控技术鉴别与觉醒相关的功能网络,同时融入了多尺度转录组学分析,深入挖掘了神经网络底层的基因表达和细胞构筑特征,发现了钾离子通道在 ILN 驱动觉醒网络中的兴奋性细胞和 PVALB+ 细胞中的关键作用。除了应用于麻醉场景,这项研究还为探索细胞和分子机制如何支撑人类大脑各种高级功能(如注意力、记忆、决策等)开辟了全新的研究思路。
复旦大学附属华山医院麻醉科张钊博士和北大-清华生命科学联合中心博士生(一年级)黄翊淳为该文共同第一作者,上海交通大学自然科学研究院陈潇宇博士,首都医科大学天坛医院神经外科杨艺主任医师,中国科学院昆明动物所吕龙宝正高级工程师、王建红副研究员等共同参与完成此项目,王征研究员与复旦大学附属华山医院麻醉科王英伟教授、河南省人民医院医学影像科王梅云主任共同为本文的通讯作者。本课题得到了科技部科技创新2030-“脑科学与类脑研究”,国家自然科学基金委,广东省及北大-清华生命科学联合中心的资助。
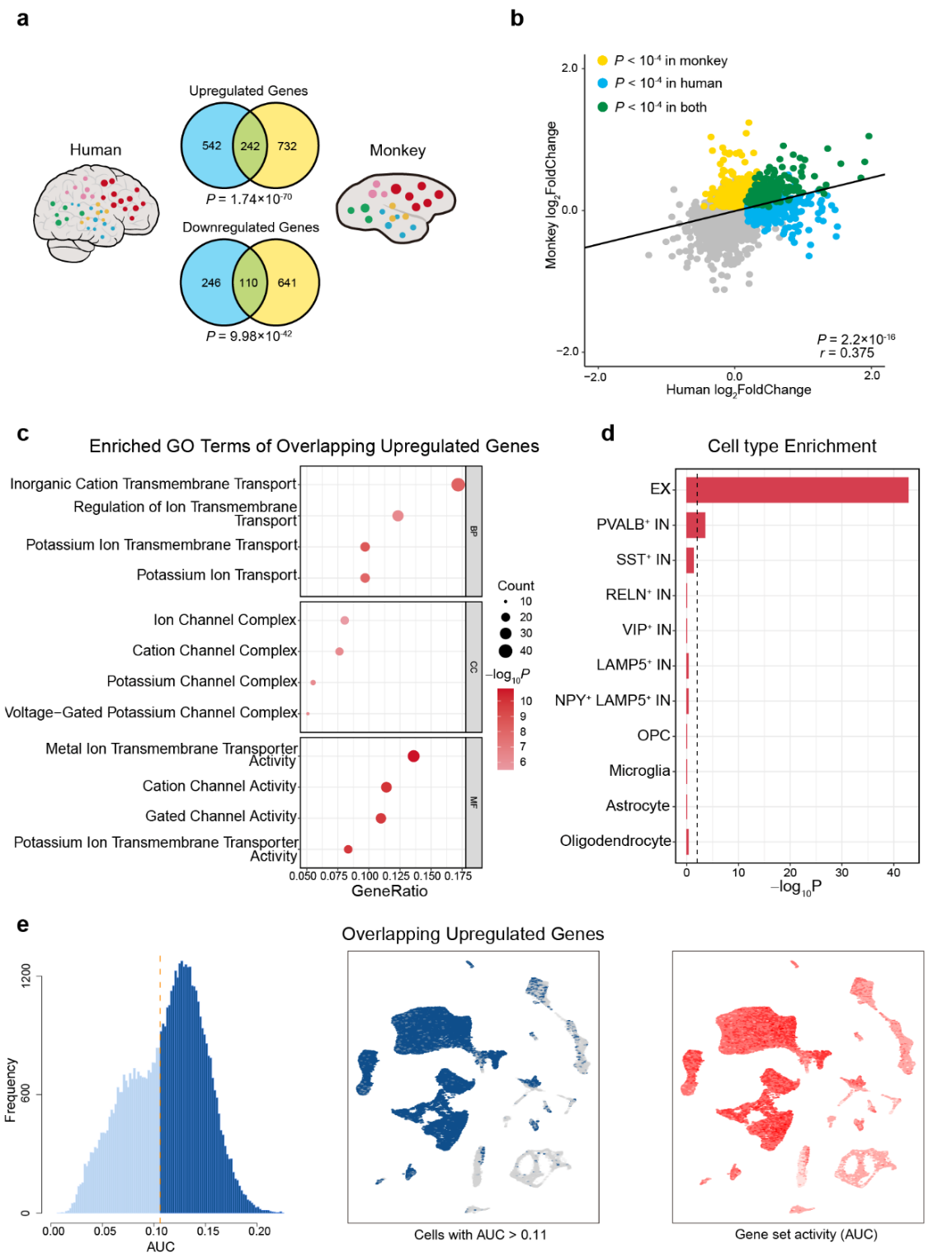
图4. ILN驱动觉醒网络的基因表达和细胞富集特征跨物种比较
原文链接:https://doi.org/10.1002/advs.202402718
2024-06-28